Perbezaan antara titisan asid-asid dan titisan redoks | Titik Asid-Titik vs Titik Redoks
Perbezaan Utama - Titik Asid-Titik vs. Titik Redoks
Secara umum, titrasi digunakan untuk menentukan kepekatan penyelesaian yang tidak diketahui (analyte). Kaedah titrimetrik yang paling biasa digunakan ialah titrasi asid dan titisan redoks. Perbezaan utama antara titrasi asid dan titisan redoks adalah sifat tindak balas yang berlaku antara titran dan analit dalam titrasi. Dalam titrasi asid-asas, tindak balas peneutralan berlaku dan dalam titis redoks, reaksi redoks berlaku (tindak balas pengoksidaan dan tindak balas pengurangan). Penggunaan penunjuk adalah kaedah yang paling biasa digunakan untuk menentukan titik akhir tindak balas.
Apakah Titisan Asid-Asam?
Dalam titrations asid-asid, asid (titrikan berasid) atau asas (titrasi asas) digunakan sebagai titran. Contoh-contoh asid yang digunakan dalam titratan berasid adalah H 2 SO 4 , HCl, atau HNO 3. Titrants asas yang digunakan adalah NaOH, K 2 CO 3 atau Na 2 CO 3. Titrikasi berasas asid boleh diklasifikasikan sebagai berikut bergantung kepada kekuatan asid dan asasnya.
- Asid kuat - titisan asas yang kukuh
- Titik asas asid yang lemah
- Asid lemah - titapan asas yang kuat
- Asid lemah - titapan asas lemah
- Titrikasi asas, penunjuk digunakan untuk menentukan titik akhir tindak balas. Penunjuk yang berbeza digunakan bergantung pada jenis titrasi seperti yang dinyatakan di atas.
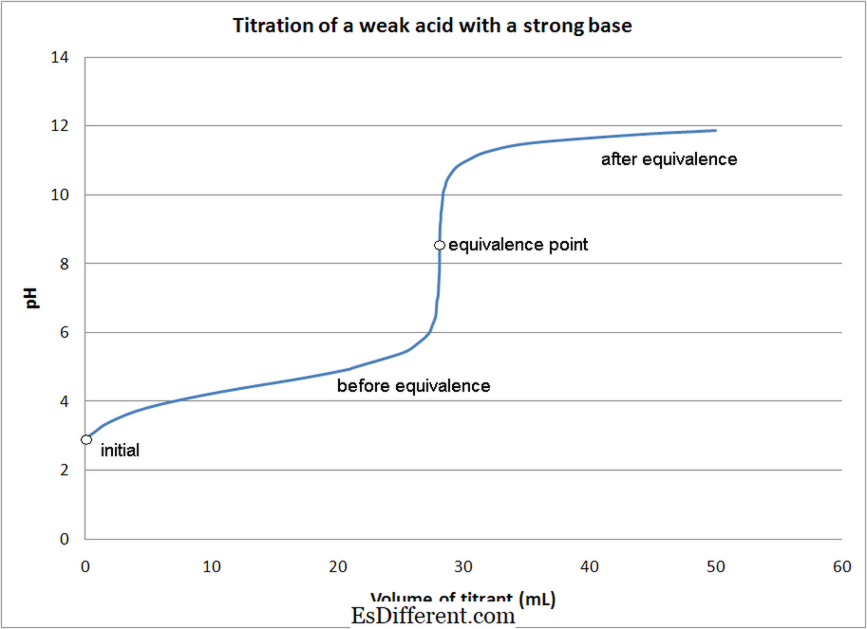
Apakah Titisan Redoks?
Penetapan redoks melibatkan reaksi redoks. Reaksi redoks mempunyai dua reaksi; tindak balas pengoksidaan dan tindak balas pengurangan. Kedua-dua proses pengoksidaan dan pengurangan berlaku pada masa yang sama di mana membolehkan kita menentukan penyelesaian tindak balas. Ini juga dikenali sebagai titik akhir titrasi. Ini boleh ditentukan dalam beberapa cara; menggunakan elektrod indikator, petunjuk redoks (penunjuk menghasilkan warna yang berbeza pada keadaan pengurangan pengoksidaan), dan indikator bukan redoks (penunjuk menghasilkan warna apabila lebihan jumlah penambahan ditambahkan).

Apakah perbezaan antara Titrasi Asid dan Titik Redoks?
Sifat tindak balas:
Titrasi Asid Asas: Titrasi berasid berasaskan melibatkan tindak balas peneutralan antara analit (penyelesaian dengan kepekatan yang tidak diketahui) dan titran berasid atau asas.
Redox Titration: Reaksi redoks melibatkan reaksi pengoksidaan dan pengurangan antara analit dan titran. Tidak ada peraturan yang mengoksidakan komponen dan mana yang dikurangkan. Sama ada analit atau titran mengoksidakan, dan komponen yang lain akan mengurangkan dengan sewajarnya.
Penentuan titik akhir:
Titik Asid Asid: Secara amnya, penunjuk pH, meter pH atau meter konduktans digunakan untuk menentukan titik akhir titrasi berasaskan asid.
Titik Redoks: Kaedah yang paling biasa digunakan untuk menentukan titik akhir tindak balas redoks menggunakan potensiometer atau penunjuk redoks. Tetapi, paling kerap sama ada analit atau titran menghasilkan warna di titik akhir. Sehingga, penunjuk tambahan tidak diperlukan dalam kes tersebut.
Contoh:
Titik Asid-Asid:
- diff Artikel Tengah sebelum Jadual ->| Jenis | Reaksi (Petunjuk) |
| Asid kuat - titrasi asas yang kuat | HCl + NaOHàNaCl + H 2 O (Phenolphthalein / asid kuat - titrasi asas yang lemah |
| HCl + NH | 3 à NH 3 Cl (Methyl orange) CH |
| 3 | COOH + NaOHa CH 3 COONa + H 2 O (Phenolphthalein) COOH + NH |
| 3 | ACH 3 COO - + NH 4 + Titik Redox: 2 KMnO 4 + 5 H 2 |
C
2 O 4 + 6 HCl → 2 MnCl 2 + 2KCl + 10 CO 2 + 8 H 2 O (+ 7) (+3) (+2) 4) Dalam reaksi di atas, permanganat dikurangkan sementara asid oksalat dioksidakan. Apabila tindak balas selesai, warna ungu permanganat berubah menjadi tidak berwarna. KMnO 4 + 5FeCl 2
+ 8HCl
→
5FeCl 3 + MnCl 2 + KCl + 4H 2 O (+ 7) (+2) (+3) (+2) Image Courtesy: 1. Titrasi asid lemah dengan pangkalan kuat Oleh Quantumkinetics (Kerja sendiri) [CC BY 3. 0], melalui Wikimedia Commons 2. "Winkler Titration Prior Titration" oleh Willwood [CC BY-SA 3. 0] via Commons




