Perbezaan Antara Monatom dan Diatomik | Monatomik vs Diatomik
Perbezaan antara monatomik dan diatomik adalah terutamanya berkaitan dengan atom-atom yang terdapat dalam spesies tersebut. Seperti yang dicadangkan oleh nama-nama, kedua-dua istilah ini bertentangan dengan persatuan-persatuan atom yang berbeza di mana 'mono' bermaksud 'satu' dan 'di' bermaksud 'dua'. Oleh itu, semata-mata, monatom bermakna satu atom
'dan atom diatomik' dua atom. ' Walau bagaimanapun, terdapat banyak variasi yang berbeza untuk definisi asas ini. Apa itu Monatom?
Apabilaatom tunggal wujud sendiri
(yang jarang berlaku), kita menyebutnya monatomik. Ini bermakna unsur-unsur dalam bentuk singular murni mereka. Satu-satunya contoh praktikal yang mungkin terdapat di bawah kategori ini adalah gas-gas mulia yang wujud sebagai atom sendiri kerana mereka memiliki shell luar mereka selesai dengan oktet elektron. Oleh itu, mereka tidak mahu menerima atau menyumbangkan sebarang elektron supaya lebih stabil. Oleh itu, gas mulia stabil dalam bentuk monatomik. Beberapa contoh adalah; Dia - Helium, Ne - Neon, Ar - Argon, Xe - Xenon, Kr - Krypton, Rn - Radon.
Helium
Apakah Diatomik?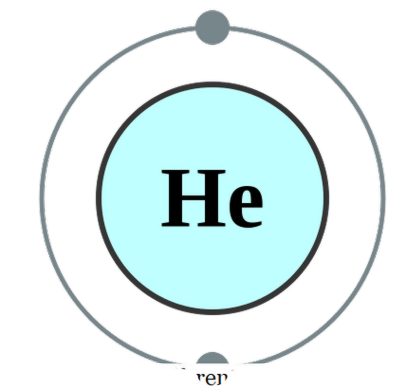
Apabila
dua atom bersekutu satu sama lain
, kita menyebutnya diatomik. Atom ini boleh dari jenis yang sama atau berbeza. Apabila mereka adalah dua atom yang sama dalam persatuan kita menyebutnya ' diatom homonuclear ' dan jika ia diperbuat daripada pelbagai jenis, kita menyebutnya sebagai diatom heteronuklear '. Contoh-contoh bagi beberapa diatom homonuklear adalah O2, N2, H2, dan lain-lain manakala CO, NO, HCl, dan lain-lain boleh diberikan sebagai contoh untuk diatom heteronuklear. Oksigen Diatoms boleh dipertimbangkan sebagai sebatian kerana mereka membentuk persatuan ini untuk mencapai lebih banyak kestabilan dengan berkongsi elektron antara satu sama lain supaya kedua-dua atom mencapai konfigurasi elektronik gas mulia. Mereka boleh mengikat melalui ikatan kovalen dengan tumpang tindih orbital atom atau mereka boleh membentuk ikatan ionik di antara mereka yang merupakan daya tarikan antara spesies yang dikenakan positif dan spesies yang bermuatan negatif. Contoh-contoh bagi ikatan kovalen antara diatoms termasuk CO, NO, dan lain-lain dan HCl boleh dianggap sebagai spesies dengan watak tarikan ionik. Walau bagaimanapun, kerana daya tarik antara H + dan Cl- tidak begitu kuat, ia bukan merupakan contoh yang sangat baik untuk ikatan ionik yang merupakan topik lain yang ditakrifkan. Apakah perbezaan antara Monatom dan Diatomik?
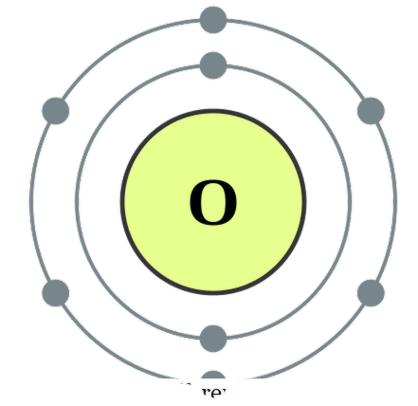
• Spesies monatom mempunyai satu atom manakala spesies diatomik mempunyai dua atom.
• Spesies monatom umumnya tidak stabil, tetapi spesies diatomik secara amnya stabil.
• Gas mulia hanya monatomik dan tidak terdapat dalam bentuk diatomik.
• Ikatan kimia wujud di antara spesies diatomik sedangkan tiada ikatan dalam spesies monatomik.
Imej ihsan:
Konfigurasi elektron Helium oleh Pumbaa (CC BY-SA 2. 0 uk)
Konfigurasi elektron oksigen oleh DePiep (CC BY-SA 3. 0)


