Perbezaan antara Nitrat dan nitrit
Nitrate vs Nitrite
Kedua-dua nitrat dan nitrit adalah anion oksit Nitrogen. Walaupun kedua-dua mereka kelihatan sama, terdapat perbezaan di antara mereka. Perbezaan ini boleh berkaitan dengan struktur, ikatan, bentuk geometri, keadaan pengoksidaan Nitrogen, kereaktifan kimia, penggunaannya dan lain-lain. Perbezaan ini terutama dibincangkan di sini.
NO 3 - ion adalah asas konjugasi HNO 3 (asid nitrik V) yang merupakan asid yang kuat. Ia adalah molekul planer dengan sp 3 hibridisasi dalam atom Nitrogen. Ketiga-tiga atom oksigen adalah bersamaan. Terdapat 24 elektron dalam cangkang valensi. NO 3 - ion mempunyai berat molekul 62. 004 g mol -1 .
NO 2 - ion adalah asas konjugasi HNO 2 (asid nitrik III) yang asid lemah (pKa = 3. Ia juga merupakan molekul planer dengan sp 2 hibridisasi. Dalam cangkang valensi, terdapat hanya 18 elektron. NO 2 - ion mempunyai berat molekul 46. 006 g mol -1 .
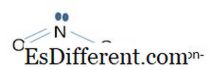

Apabila ikatan di kedua-dua ion itu dipertimbangkan, di NO 3 - ion pi ikatan melibatkan empat 2p z orbital atom (satu orbitla dari N dan tiga orbital dari 3 atom oksigen). Empat orbital atom ini membentuk 4, orbital molekul pi yang berpusat empat. Orbital molekul dengan tenaga terendah adalah orbital ikatan. Orbital dengan tenaga terbesar ialah orbital anti-ikatan. Dua orbital yang lain merosot (sama dengan tenaga) yang merupakan orbital bukan ikatan. Dalam hal NO 2 - ion, ikatan pi hanya melibatkan tiga atom 2p z orbital atom. Di sini, orbit dengan tenaga yang paling rendah ialah orbital ikatan, satu pertengahan adalah orbital bukan ikatan, dan yang lain adalah orbital anti-ikatan. Di kedua-dua ion, orbital ikatan melibatkan dalam membuat orbital σ-ikatan (ikatan sigma) dan bukan ikatan yang melibatkan dalam membuat ikatan-ikatan (pi-bon). Oleh itu, dalam NO 3 - ion setiap ikatan mempunyai susunan ikatan 1 1 / 3 . 1 dari σ-bon dan 1 / 3 dari ikatan π. Di dalam ion NO 2 - , pesanan ikatan adalah 1 1 / 2 . 1 dari σ-bon dan 1 / 2 dari ikatan π.
Walaupun, kedua-dua ion adalah dari geometri elektronik yang sama, kerana pesanan bon berbeza, bentuk geometri mereka juga berbeza. Ion NO 3 - mempunyai bentuk segi tiga pelan dan ion NO 2 - mempunyai bentuk sudut (atau V . Sudut ikatan juga berbeza. Sudut ikatan ONO ion 3 - ion dan NO 2 - ion masing-masing 120 0 dan 115 0 . Keadaan oksidasi Nitrogen dalam ion NO 3 - dan ion NO 2 - masing-masing adalah +5 dan +3.Kerana sebab-sebab ini (terutamanya perbezaan ikatan), kereaktifan kimia (seperti asas, keupayaan pengoksidaan / pengurangan, produk penguraian terma dari sebatian terdiri daripada ion-ion ini) juga berbeza.
Dalam praktiknya, ion NO 2 - adalah pangkalan yang lemah manakala ion NO 3 - adalah pangkalan yang sangat lemah. Apabila keadaan pengoksidaan atom Nitrogen dalam ion ini diambil kira, ion NO 2 - boleh bertindak sebagai ejen pengurangan serta agen pengoksidaan manakala NO 3 - ion hanya boleh bertindak sebagai agen pengoksida.

Contoh produk yang diperoleh daripada penguraian haba NO 3 - dan NO 2 - ion yang mengandungi sebatian diberikan di bawah untuk menunjukkan perbezaan dalam kereaktifan.

Malah, apabila mereka membentuk kompleks dengan ion logam, mereka berkelakuan dengan cara yang berbeza. Iaitu, NO 2 - ion bertindak sebagai ligan monodentat sementara NO 3 - ion berfungsi sebagai ligan berbisa.
Perbezaan dalam reaktiviti kimia ini membantu kita membezakan penggunaannya. Sebagai contoh, nitrit biasanya digunakan dalam pemprosesan daging (kadang kala nitrat juga digunakan), dan nitrat digunakan untuk menghasilkan bahan peledak. Nitrat secara semula jadi dan kanser. Tetapi Nitrite tidak kanser.




