Perbezaan antara tekanan separa dan tekanan wap
Tekanan separa dan tekanan wap biasanya digunakan istilah saintifik yang berkaitan dengan jumlah tekanan yang dikenakan oleh komponen sistem, tetapi identiti mereka boleh mengelirukan kepada orang lain. Terdapat perbezaan yang jelas antara istilah ini termasuk kesan dan identiti mereka. Artikel ini akan menjelaskan lebih lanjut tentang perbezaan antara istilah ini. Ia juga akan merangkumi beberapa contoh untuk mengabadikan aplikasi itu.
Mari kita mulakan dengan menonjolkan konsep tekanan sebelum kita dapat menyelidiki perbezaan antara wap dan tekanan separa. Tekanan secara saintifik ditakrifkan sebagai daya yang dikenakan bagi kawasan unit pada objek atau bahan. Ia juga boleh ditakrifkan sebagai daya yang digunakan oleh zarah bertabrakan antara satu sama lain dan ia sering diukur menggunakan Pascal. Dalam hal pelanggaran zarah, persamaan gas dan teori kinetik gas digunakan untuk mengira tekanan.
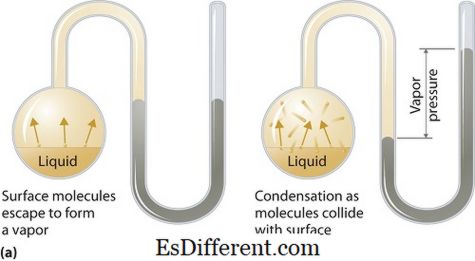
Apakah tekanan wap?
Tekanan wap boleh digunakan untuk fasa cecair atau pepejal. Ia adalah tekanan yang dikenakan oleh wap dalam keseimbangan termodinamik pada keadaan cecair atau pepejal pada suhu tertentu dalam sistem tertutup apabila kedua-dua wap dan cecair (pepejal) bersentuhan. Tekanan ini timbul akibat pengewapan, yang dibolehkan oleh peningkatan haba pada pepejal atau cecair. Oleh itu, suhu digunakan sebagai ukuran pengewapan dan ia berkadar terus dengan tekanan wap. Ini bermakna, semakin tinggi suhu adalah semakin tinggi tekanan wap.
Semasa pengewapan, molekul udara melarikan diri sebagai akibat daripada tenaga kinetik yang lebih tinggi ke udara dalam sistem tertutup. Kemudian apabila dalam keseimbangan, tekanan wap timbul di antara wap dan bentuk cecair yang padat (pepejal). Dalam penyelesaian di mana daya intermolecular lemah, tekanan wap cenderung lebih banyak, dan sebaliknya, dalam penyelesaian di mana daya intermolecular lebih kuat, tekanan wap kurang.
Tekanan wap juga boleh berlaku dalam campuran yang sesuai seperti yang dijelaskan oleh Undang-undang Raoult. Ia menyatakan bahawa tekanan wap separa komponen tertentu dalam campuran cecair atau pepejal adalah sama dengan tekanan wap komponen itu yang didarabkan oleh pecahan mol dalam campuran itu pada suhu tertentu. Contoh di bawah akan menggambarkannya.
Contoh 1.
Diberi campuran ideal 0 0 5 mol. etanol dan 1. 5 mol. metanol dengan tekanan wap 30KPa dan 52KPa, masing-masing, menentukan tekanan wap separa bagi setiap komponen.
Penyelesaian:
Jumlah tahi lalat ialah 1. 5mol + 0. 5mol = 2. 0mol. Menurut Undang-undang Raoult, tekanan wap separa adalah sama dengan tekanan wap yang didarabkan oleh pecahan molar komponen itu.Dalam kes ini, P methanol = 1. 5/2 * 52 = 39KPa dan P etanol = 0. 5/2 * 30 = 7. 5KPa.
Apabila anda mempunyai tekanan wap separa komponen dalam campuran, anda boleh mendapatkan tekanan wap keseluruhan dengan menambahkannya bersama-sama. Dalam hal ini, 7. 5 + 39 memberikan 46. 5KPa tekanan wap keseluruhan campuran penyelesaian etanol dan metanol.
Faktor yang mempengaruhi tekanan wap
Pengenalan molekul
Seperti yang telah disebutkan di atas, jenis daya molekul menentukan jumlah tekanan wap yang akan dikenakan. Sekiranya daya lebih kuat, maka tekanan wap yang kurang muncul, dan jika lebih lemah, maka tekanan wap yang lebih tinggi akan timbul. Oleh itu, komposisi cecair atau pepejal akan memberi kesan kepada tekanan wap.
Suhu
Suhu yang lebih tinggi membawa kepada tekanan wap yang lebih tinggi kerana ia mengaktifkan lebih banyak tenaga kinetik untuk memecahkan daya molekul supaya molekul dapat melepaskan permukaan cecair dengan cepat. Apabila tekanan wap (tekanan wap tepu) sama dengan tekanan luaran (tekanan atmosfera), cecair akan mula mendidih. Suhu yang lebih rendah akan menghasilkan tekanan wap yang rendah dan akan mengambil masa untuk cecair mendidih.

Undang-undang Tekanan Separa Dalton
Apakah tekanan separa?
Idea tekanan separa pertama dicadangkan oleh saintis terkenal John Dalton. Ia melahirkan Tekanan Separa Undang-undangnya yang menyatakan bahawa tekanan keseluruhan yang dihasilkan oleh campuran gas ideal adalah sama dengan jumlah tekanan separa gas individu. Katakan suatu bekas tertentu dipenuhi dengan gas Hidrogen, Nitrogen dan Oksigen, jumlah tekanan, P TOTAL, akan sama dengan jumlah oksigen, nitrogen dan hidrogen. Tekanan separa setiap gas dalam campuran itu dikira dengan mengalikan jumlah tekanan oleh pecahan molar gas individu.
Ringkasnya, tekanan separa ialah tekanan yang dikenakan oleh gas tertentu dalam campuran seolah-olah ia bertindak secara bersendirian dalam sistem. Oleh itu, anda mengabaikan gas lain apabila menentukan tekanan separa gas individu. Teori ini boleh disahkan dengan menyuntik, katakan, 0. 6atm O 2 dalam kontena 10. 0 L pada 230K dan kemudian menyuntik 0. 4atm N 2 dalam bekas yang sama dari saiz yang sama pada suhu yang sama, dan akhirnya menggabungkan gas untuk mengukur tekanan total; ia akan menjadi jumlah kedua-dua gas tersebut. Ini jelas menjelaskan tekanan separa gas individu dalam campuran gas bukan reaktif.
Mengira tekanan separa
Untuk mengira tekanan separa adalah angin mutlak kerana undang-undang Dalton [1] menyediakan peruntukan untuk itu. Ia bergantung kepada maklumat biasa yang disediakan. Jika, misalnya, jumlah tekanan diberikan untuk campuran gas A dan B serta tekanan gas A, tekanan separa B dapat dihitung dengan menggunakan P TOTAL = P A + P B . Selebihnya adalah manipulasi algebra. Tetapi dalam kes di mana hanya jumlah tekanan campuran yang diberikan, anda boleh menggunakan pecahan molar gas B untuk menentukan tekanan separa.Fraksi molar, dilambangkan oleh X, boleh didapati dengan membahagikan tahi lalat gas B dengan jumlah tahi campuran gas. Kemudian untuk mencari tekanan separa, anda akan membiak pecahan molar, X, dengan jumlah tekanan. Contoh di bawah menghuraikannya.
Contoh 2.
Campuran Nitrogen dan Oksigen, dengan 2. 5 mol dan 1. 85 mol, masing-masing disuntik dalam bekas 20. 0L dengan jumlah tekanan 4atm; hitung tekanan separa yang dikenakan oleh gas oksigen.
Penyelesaian:
Jumlah tahi lalat dalam campuran adalah 2. 5 + 1. 85 = 4. 35 mol. Jadi pecahan molar Oksigen, X o , akan menjadi 1. 85 mol / 4. 35 mol = 0. 425 mol. Tekanan separa Oksigen akan menjadi 0. 425 * 4atm = 1. 7atm. Tekanan separa gas yang selebihnya dapat dikira mengikut pendekatan yang sama atau boleh dikira dengan menggunakan gas Oksigen dan tekanan total seperti yang dihuraikan oleh Tekanan Separa Undang-undang Dalton bahawa jumlah tekanan gas tidak reaktif adalah sama dengan jumlah tekanan separa.
Perbezaan antara wap dan tekanan separa
Dari penjelasan di atas, jelas bahawa tekanan wap dan tekanan separa adalah dua tekanan yang berbeza. Tekanan wap digunakan pada fasa cair dan pepejal sementara tekanan parsial dikenakan pada fasa gas. Tekanan wap dikenakan dalam peralihan fasa selepas haba yang mencukupi telah ditambahkan ke larutan itu sehingga menyebabkan molekulnya melarikan diri dalam sistem tertutup.
Perbezaan utama antara tekanan separa dan tekanan wap adalah bahawa tekanan separa adalah tekanan yang dikenakan oleh gas individu dalam campuran seolah-olah ia bersendirian dalam sistem itu, manakala tekanan wap merujuk kepada tekanan yang dikenakan oleh wap dalam keseimbangan termodinamik dengan keadaan cecair atau pepejalnya. Jadual di bawah memberikan perbandingan ringkas mengenai tekanan ini.
| Tekanan Wap | Tekanan Separa |
| Ia ditunjukkan oleh wap cecair atau pepejal pada fasa pekat dalam keseimbangan | Ia ditunjukkan oleh gas individu dalam campuran gas bukan reaktif |
| Baik dijelaskan oleh Raoult's Undang-undang | Baik dijelaskan oleh Undang-undang Dalton |
| Terpakai dalam fasa padat dan cair | Terpakai dalam fasa gas hanya |
| Bebas dari permukaan atau volume sistem | Dikira menggunakan gas dalam jumlah |
| Dikira menggunakan pecahan tahi lalat | Dikira menggunakan pecahan tahi lalat gas |
Wrap Up! Tekanan wap dan tekanan separa adalah dua istilah saintifik penting yang digunakan dalam menentukan kesan daya yang digunakan oleh wap dan gas masing-masing, dalam sistem tertutup yang diberikan pada suhu tertentu. Perbezaan utama mereka ialah kawasan permohonan dengan tekanan wap yang digunakan pada fasa cecair atau pepejal, manakala tekanan separa digunakan pada gas individu dalam campuran gas ideal dalam jumlah tertentu.
Tekanan separa dikira dengan mudah dengan mengikuti Undang-undang Tekanan Separa Dalton, manakala tekanan wap dikira dengan menggunakan Undang-undang Raoult.Dalam sebarang campuran yang diberikan, setiap komponen gas menimbulkan tekanan sendiri, yang dipanggil tekanan separa bebas daripada gas lain. Dan apabila anda menggulung tahi lalat dari mana-mana komponen dengan suhu yang tetap berterusan, anda akan meningkatkan tekanan separa. Menurut hubungan Clausius-Clapeyron [2], tekanan wap meningkat apabila suhu meningkat.
Dengan maklumat yang disebutkan di atas, anda harus dapat membezakan antara tekanan wap dan tekanan separa. Anda juga harus dapat mengira mereka menggunakan pecahan molar dan didarab dengan jumlah tekanan. Kami telah memberikan anda contoh tipikal untuk menghuraikan penggunaan tekanan ini.



