Perbezaan Antara S dan P Elemen Blok | S vs P Elemen Blok
vs Elemen Blok P
Perbezaan utama antara unsur s dan p blok boleh dijelaskan dengan baik menggunakan konfigurasi elektronik mereka. Dalam unsur-unsur blok s, elektron terakhir mengisi ke subseksyen s dan dalam elemen blok p, elektron terakhir mengisi ke bawah p. Apabila mereka membentuk ion; elemen blok s menghilangkan elektron mereka dari subsub paling luar paling mudah manakala elemen blok p menerima elektron pada subseksyen p atau mengeluarkan elektron dari p-subshell. Sesetengah unsur dalam kumpulan p-membentuk ion positif yang mengeluarkan elektron dari p-subseksal paling luar dan beberapa elemen (elemen elektronegatif yang paling) membentuk ion negatif yang menerima elektron daripada yang lain. Apabila anda menganggap sifat kimia, terdapat perbezaan yang signifikan antara unsur s dan p blok; ini pada dasarnya disebabkan oleh konfigurasi elektron.
Apakah unsur S-block?
S-blok elemen adalah unsur kimia dalam kumpulan I dan kumpulan II dalam jadual berkala. Oleh kerana subshell s boleh menampung hanya dua elektron, unsur-unsur ini biasanya mempunyai satu (kumpulan I) atau dua (kumpulan II) elektron dalam shell terluar. Unsur dalam kumpulan I dan II ditunjukkan di atas dalam jadual.
- diff Artikel Tengah sebelum Jadual ->| IA | II A | |
| 2 | Li | Be |
| 3 | Na | Mg |
| 4 | K | Ca |
| 5 | Rb | Sr |
| 6 | Cs | Ba |
| 7 | Fr | Ra |
| IA | Logam alkali |
| II A | Logam bumi alkali |
Semua elemen dalam bentuk s-blok ion positif dan mereka sangat reaktif.
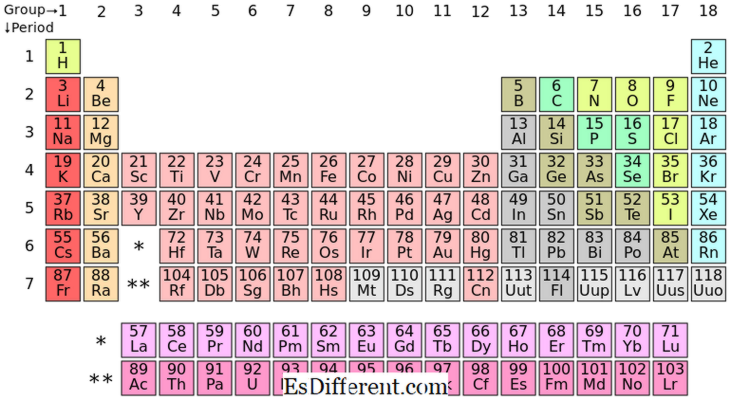
Penempatan Elemen S-blok dalam Jadual Berkala
Apakah unsur-unsur P-blok?
P-blok elemen adalah unsur-unsur yang elektron terakhirnya menjadi subkulit. Terdapat tiga orbital p; setiap orbit boleh menampung dua elektron, menjadikan jumlah enam p-elektron. Oleh itu, elemen p-block mempunyai satu hingga enam p-elektron dalam shell luar. Blok P mengandungi kedua-dua logam dan bukan logam; Di samping itu terdapat juga beberapa metaloid.
| 13 | 14 | 15 | 16 | 17 | 18 | |
| 2 | B | C | N | O | F | 3 |
| Sb | > Bi | Po | ||||
| Pada | Rn | Apakah perbezaan antara S dan P Elemen blok?Konfigurasi Elektron biasa: | S-block Elements: | S-block elements mempunyai konfigurasi elektron biasa [gas mulia] ns | 1 | (untuk unsur-unsur kumpulan I)] ns |
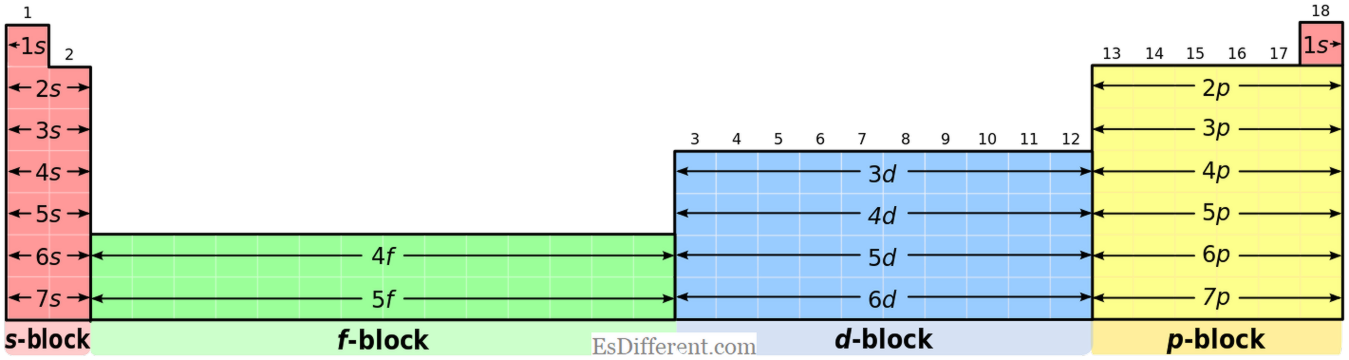
2
(untuk unsur kumpulan II). Unsur-unsur blok P
P-blok mempunyai konfigurasi elektron biasa [gas mulia] ns 2 np 1-6 . Tetapi, helium mempunyai konfigurasi 1 2
; ia adalah keadaan istimewa. Negara Pengoksidaan: Elemen S-blok: S-blok elemen tidak menunjukkan banyak keadaan pengoksidaan seperti elemen p-blok. Sebagai contoh, elemen-elemen kumpulan I menunjukkan +1 negeri pengoksidaan dan kumpulan II menunjukkan +2 negeri pengoksidaan. Unsur-unsur blok P: Tidak seperti unsur-unsur s-blok, elemen p-blok mempunyai keadaan pengoksidaan yang sama untuk kumpulan masing-masing dalam jadual berkala dan beberapa keadaan pengoksidaan tambahan yang lain bergantung kepada kestabilan ion. 14 15 16
17
18 Konfigurasi elektron umum
ns 2




