Perbezaan Antara Octet dan Duplet | Octet vs Duplet
Perbezaan Utama - Octet vs Duplet
Terdapat atom yang aktif dan tidak aktif atau sebatian yang ada sekarang. Ciri ini bergantung terutamanya kepada bilangan elektron yang terdapat pada cangkang paling luar atom. Atom yang mempunyai kerang tidak lengkap mungkin menjadi aktif untuk menyelesaikan konfigurasi elektron mereka untuk menjadi stabil. Atom yang tidak aktif mempunyai konfigurasi elektron lengkap; oleh itu, atom-atom ini tidak bertindak balas dengan atom lain melainkan dalam keadaan khusus. Gas mulia selalu tidak aktif. Oleh itu, mereka dikenali sebagai gas lengai. Gas lengai berada dalam lajur kelapan dalam jadual berkala. Unsur-unsur lain dalam tempoh yang sama (baris) cenderung untuk mendapatkan konfigurasi elektron gas inert pada akhir tempoh itu, yang merupakan bentuk yang paling stabil. Atom aktif cenderung untuk menyelesaikan bilangan elektron mengikut peraturan oktet atau peraturan duplet . Perbezaan utama di antara oktet dan duplet ialah oktet adalah atom atau ion yang mempunyai maksimum lapan elektron dalam shell terluar manakala duplet adalah atom yang mempunyai maksimum dua elektron di shell terluar.
KANDUNGAN
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah satu Octet
3. Apakah Duplet
4. Perbandingan Side by Side - Octet vs Duplet
5. Ringkasan
Apakah satu Octet?
Suatu oktet adalah atom atau ion yang mempunyai lapan elektron dalam shell terluar atom itu. Semua gas mulia kecuali helium mempunyai lapan elektron dan bersifat lengai. Konfigurasi elektron gas mulia akan selalu berakhir seperti berikut.
Contohnya, konfigurasi elektron Neon adalah 1s2 2s 2 ns
2 2p 6 . Neon adalah gas lengai. Unsur lain yang mempunyai tujuh, enam, dan lain-lain elektron di orbital terluar cenderung mematuhi peraturan oktet dengan mendapatkan elektron dari luar; beberapa elemen lain yang mempunyai satu, dua, dan lain-lain elektron cenderung kehilangan elektron dan mendapatkan konfigurasi elektron gas inert terdekat. Tetapi unsur-unsur lain di tengah-tengah jadual berkala akan membentuk ikatan baru dengan unsur-unsur yang mempunyai elektron berlebihan untuk berkongsi elektron tersebut dan menjadi oktet.
Apa itu Duplet?
Atom hidrogen dan atom helium adalah elemen terkecil dalam alam dan hanya mempunyai satu orbit di sekeliling nukleusnya. Orbital ini dipanggil 1s orbital. Orbital ini boleh mengandungi maksimum dua elektron. Atom hidrogen mempunyai satu elektron dan helium mempunyai dua elektron. Oleh itu, helium dipanggil duplik.Helium mempunyai bilangan elektron maksimum yang boleh dimiliki; oleh itu ia adalah unsur yang stabil. Oleh itu, Helium juga merupakan gas lengai. Tetapi hidrogen hanya mempunyai satu elektron dan satu-satunya orbit yang tidak lengkap. Oleh itu, atom hidrogen sahaja sangat reaktif dan ia cenderung membentuk ikatan kovalen dengan atom hidrogen lain dengan berkongsi satu-satunya elektron yang mereka miliki. Kemudian atom hidrogen ini menjadi duplik kerana sekarang mereka mempunyai dua elektron di orbital terluar mereka. Tetapi Lithium juga boleh berkelakuan sebagai duplik dengan membuang elektron dari orbital terluarnya. Konfigurasi elektron Lithium adalah 1s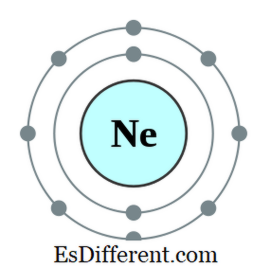
2
2s
1 . Dengan mengeluarkan 2s 1 elektron, ia boleh menjadi duplik. Dalam kes itu, Dia, H - dan Li + adalah duplik yang boleh wujud sebagai duplik yang stabil. Semua duplik mempunyai konfigurasi elektron yang berakhir seperti berikut. ns 2
Rajah 02: Helium, duplik
Apakah perbezaan antara Octet dan Duplet? - Diff Artikel Tengah sebelum Jadual ->

Octet vs Duplet
Octet mempunyai lapan elektron di cangkang luar.
Duplet mempunyai dua elektron dalam cangkang paling luar.
Konfigurasi Elektron biasa |
|
| Octet mempunyai ns | 2 |
| np | |
| 6 jenis konfigurasi elektron pada akhir. Duplet mempunyai konfigurasi jenis 2 pada akhir. | Bilangan Orbitals Octet mungkin mempunyai sekurang-kurangnya dua orbital. Duplek hanya mempunyai satu orbit. |
| Jenis Orbitals | |
| Satu oktet boleh mempunyai semua jenis orbital seperti s, p, d, f, dll. | Duplet hanya mempunyai orbit. |
| Ringkasan - Octet vs Duplet | |
| Semua elemen cenderung menjadi stabil. Tetapi dengan konfigurasi elektron yang tidak lengkap, atom tidak boleh stabil; Oleh itu, mereka menjadi sangat reaktif untuk mengisi cangkang dengan elektron dengan memperoleh, kehilangan atau berkongsi elektron. Atom atau molekul yang mematuhi peraturan octet atau duplet stabil. Perbezaan utama antara oktet dan duplet adalah oktet mempunyai lapan elektron di orbital terluarnya manakala duplet mempunyai dua elektron dalam orbitnya. | Rujukan: |
1. Nema, P., 2011. Pengalaman cemerlang. [Dalam Talian] Boleh didapati di: // www. topperlearning. com / forum / home-work-help-19 / what-is-octet-duplet-valency-and-ion-chemistry-structure-of-the-atom-46317 / reply [Accessed 29 05 2017].
2. Chang, R., 2010. Kimia. 10 ed. New York: McGraw-Hill.
3. Anon., 2015. Penyusun gred. [Dalam Talian] Boleh didapati di: // gradestack. com / NTSE-Complete-Course / Chemical-Bonding / Chemical-Activity-of-An / 19176-3853-37737-study-wtw [Accessed 29 05 2017].
Image Courtesy:
1. "Cakera elektron 002 Helium - tiada label" Oleh Pumbaa (kerja asal oleh Greg Robson) - Gambar rajah elektron shell (versi bertanda yang bersangkutan) (CC BY-SA 2. 0 uk) melalui Wikimedia Commons
2. "Electron shell 010 Neon" Oleh Pumbaa (kerja asal oleh Greg Robson) (CC BY-SA 2. 0 uk) melalui Wikimedia Commons



