Perbezaan Antara Sebatian Ionik dan Kovalen | Ionic vs Covalent Compounds
Perbezaan Utama - Ionic vs Covalent Compounds
Banyak perbezaan boleh diperhatikan antara sebatian ionik dan kovalen berdasarkan sifat makroskopik mereka seperti kelarutan dalam air, kekonduksian elektrik, titik lebur dan titik didih. Sebab utama perbezaan ini adalah perbezaan pola ikatan mereka. Oleh itu, corak ikatan mereka boleh dianggap sebagai perbezaan kunci antara sebatian ionik dan kovalen. (Perbezaan Antara Bon Ionik dan Kovalen) Apabila ikatan ionik dibentuk, elektron (s) didermakan oleh logam dan elektron yang disumbangkan diterima oleh bukan logam. Mereka membentuk ikatan yang kuat kerana tarikan elektrostatik. Bon kovalen dibentuk di antara dua bukan logam. Dalam ikatan kovalen, dua atau lebih atom berkongsi elektron untuk memenuhi peraturan oktet. Pada umumnya, bon ionik lebih kuat daripada bon kovalen. Ini membawa kepada perbezaan dalam sifat fizikal mereka.
Apakah sebatian Ionik?
Ikatan ionik dibentuk apabila dua atom mempunyai perbezaan yang besar dalam nilai elektronegatif mereka. Dalam proses pembentukan ikatan, atom elektronegatif kehilangan elektron dan lebih banyak elektronegatif atom memperoleh elektron tersebut. Oleh itu, spesis yang dihasilkan adalah ion bermuatan bertentangan dan mereka membentuk ikatan kerana tarikan elektrostatik yang kuat.
Ikatan ionik dibentuk antara logam dan bukan logam. Secara umum, logam tidak mempunyai banyak elektron valensi dalam cangkang paling luar; Walau bagaimanapun, bukan logam mempunyai lebih dekat kepada lapan elektron dalam shell valence. Oleh itu, bukan logam cenderung menerima elektron untuk memenuhi peraturan oktet. Contohnya sebatian ionik
adalah Na + + Cl - à NaCl Natrium (logam) mempunyai satu elektron valensi dan Klorin (bukan logam) tujuh elektron valens.

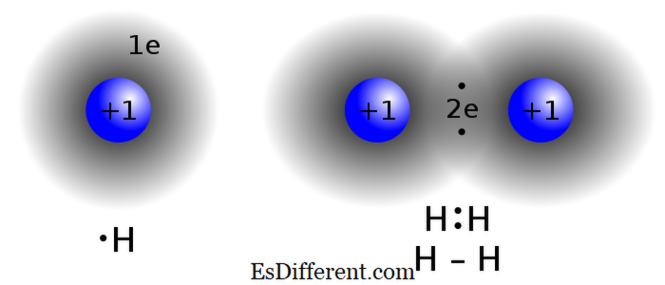
Sebatian kovalen dibentuk dengan menghidupkan elektron antara dua atau lebih atom untuk memenuhi "peraturan oktet". Jenis ikatan ini biasanya terdapat dalam sebatian bukan logam, atom-atom dari sebatian yang sama atau unsur-unsur berdekatan dalam jadual berkala. Dua atom yang mempunyai nilai elektronegativiti yang hampir sama tidak menukar (menyumbangkan / menerima) elektron dari shell valence mereka. Sebaliknya, mereka berkongsi elektron untuk mencapai konfigurasi oktet. Contoh-contoh sebatian kovalen
adalah Metana (CH
4 ), Karbon monoksida (CO), monobromida Iodin (IBr) Ikatan Kovalen Sebatian?
Definisi Sebatian Ion dan Sebatian Kovalen
Komponen Ionik:
Komponen Ionik ialah sebatian kimia kation dan anion yang dipegang bersama oleh ikatan ionik dalam struktur kisi.
Kompaun kovalen: Kompaun kovalen adalah ikatan kimia yang dibentuk oleh perkongsian satu atau lebih elektron, terutama pasangan elektron, antara atom.
Sifat-sifat sebatian ionik dan kovalen Sifat-sifat fizikal
Senyawa ionik:
Semua sebatian ionik wujud sebagai pepejal pada suhu bilik.
Sebatian ionik mempunyai struktur kristal yang stabil. Oleh itu, mereka mempunyai titik lebur yang lebih tinggi dan titik didih. Daya tarikan daya antara ion positif dan negatif sangat kuat.
- diff Perkara Tengah sebelum Jadual ->
Komponen Ionik
Penampilan| Titik Lebur | NaCl - Natrium klorida | Padu kristal putih |
| 801 ° C | KCl - Potassium chloride | Kristal vitreous putih atau tidak berwarna |
| 770 ° C | MgCl | 2 |
| - Magnesium klorida Padu kristal putih atau tidak berwarna 1412 ° C | Sebatian kovalen: Sebatian kovalen wujud dalam ketiga-tiga bentuk; sebagai pepejal, cecair dan gas pada suhu bilik. | Titik lebur dan didih mereka agak rendah berbanding sebatian ionik. |
Kompaun Covalent
Penampilan
Titik Lebur
| HCl-Hidrogen klorida | Gas tanpa warna | -114. 2 ° C |
| CH | 4 | -Methane |
| Gas tanpa warna -182 ° C CCl | 4 | -23 ° C |
| Konduktiviti Sebatian ionik: Sebatian ionik pepejal tidak mempunyai elektron bebas; oleh itu, mereka tidak menjalankan elektrik dalam bentuk padat. Tetapi, apabila sebatian ionik dibubarkan di dalam air, mereka membuat penyelesaian yang menjalankan elektrik. Dalam erti kata lain, larutan berair ionik adalah konduktor elektrik yang baik. | Sebatian kovalen: | Baik sebatian kovalen tulen mahupun bentuk larut dalam air tidak menjalankan elektrik. Oleh itu, sebatian kovalen adalah konduktor elektrik yang lemah dalam semua fasa. |
Keterlarutan
Sebatian ionik: Kebanyakan sebatian ionik boleh larut dalam air, tetapi ia tidak larut dalam pelarut bukan kutub.
Sebatian kovalen: Kebanyakan sebatian kovalen boleh larut dalam pelarut bukan kutub, tetapi tidak di dalam air.
Kekerasan
Sebatian Ionik: Pepejal ionik adalah sebatian keras dan rapuh.
Sebatian kovalen: Secara umumnya, sebatian kovalen lebih lembut daripada pepejal ionik.




